위장약 ‘라니티딘’에 이어 ‘니자티딘’ 성분이 함유된 의약품에서도 발암 추정 물질이 검출됐다.
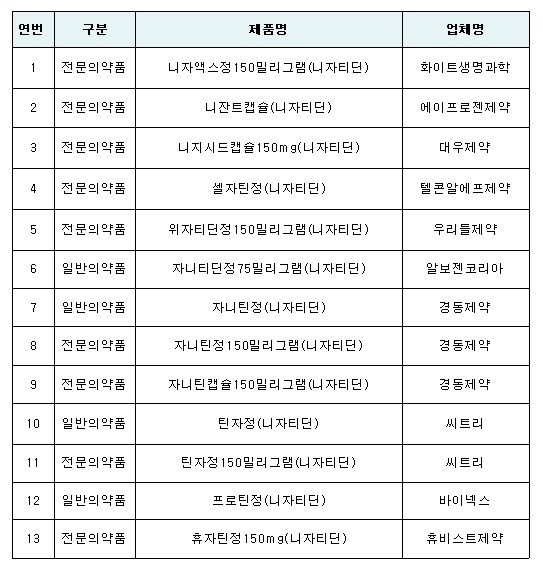
식품의약품안전처는 ‘NDMA(N-니트로소디메틸아민)’가 잠정 관리기준 미량 초과 검출된 니자티딘 완제의약품 13품목에 대해 잠정적으로 제조 및 판매를 중지하고, 처방을 제한하도록 조치했다고 22일 밝혔다.
식약처는 ‘라니티딘’과 유사한 화학구조를 가진 ‘니자티딘’ 성분 원료의약품 전체 제조번호 및 사용 완제의약품을 수거해 검사를 진행했다. 그 결과, ‘니자티딘’ 원료의약품 일부 제조번호에서 NDMA가 잠정관리기준(0.32ppm)을 미량 초과(0.34∼1.43ppm 검출)해 검출됐다. NDMA 잠정 관리기준은 니자티딘 1일 최대 복용량(300mg)을 평생 복용하는 것을 전제로, 국제의약품규제조화위원회 가이드라인과 중앙약사심의위원회의 전문가 자문결과 등을 종합적으로 검토해 설정됐다.
니자티딘의 NDMA 검출량 및 복용환자수는 발사르탄(최대검출량 112.1ppm, 36만명) 및 라니티딘(최대검출량 53.5ppm, 144만명) 보다 낮은 최대검출량 1.43ppm, 복용환자 2만2000명 수준인 것으로 나타났으며, 이는 최대검출량 기준으로 발사르탄의 78분의 1, 라니티딘의 37분의 1 수준에 해당된다.
NDMA가 검출되는 원인은 니자티딘에 포함되어 있는 ‘아질산기’와 ‘디메틸아민기’가 시간이 지남에 따라 자체적으로 미량 분해‧결합하여 생성되거나, 제조과정 중 아질산염이 비의도적으로 혼입되어 생성되는 것으로 추정하고 있다.
식약처는 전문가들로 구성된 ‘라니티딘 중 NDMA 발생원인 조사위원회’를 통해 니자티딘에서의 NDMA 생성원인에 대해서도 보다 정확한 원인을 분석할 계획이다.
아울러 식약처는 작년 발사르탄 및 최근 라니티딘·니자티딘과 같은 합성 원료의약품에서 NDMA 등 불순물이 검출됨에 따라, 원료의약품 불순물 관리대책도 마련했다.
우선 합성 원료의약품 전체에 대해 원료 제조·수입업체 및 완제의약품 제조·수입업체에서 자체적으로 NDMA 등 불순물 발생가능성에 대한 평가 및 시험을 실시하고, 발생가능성 평가결과는 2020년 5월까지, 시험결과는 2021년 5월까지 식약처에 보고토록 지시했다.
또 업체 자체조사 지시와는 별도로 식약처 차원의 원료의약품 안전관리 강화 방안을 추진한다.
식약처 자체적으로 NDMA 등 검출가능성 있는 원료의약품에 대한 연구를 지속하고, 신규원료 허가시 자료제출 의무화 한다. 해외제조소 사전등록제 도입 등을 통해 원료 해외제조소의 관리를 강화하고, 국가 간 안전정보 공유를 강화한다.
이와 함께 사르탄류에서 NDMA, NDEA 이외 검출 가능한 9종 니트로소화합물 불순물을 동시에 분석할 수 있는 시험법을 개발하고 이를 공개한다는 방침이다.
◇ 잠정 제조 및 판매중지 의약품 목록
유수인 기자 suin92710@kukinews.com










