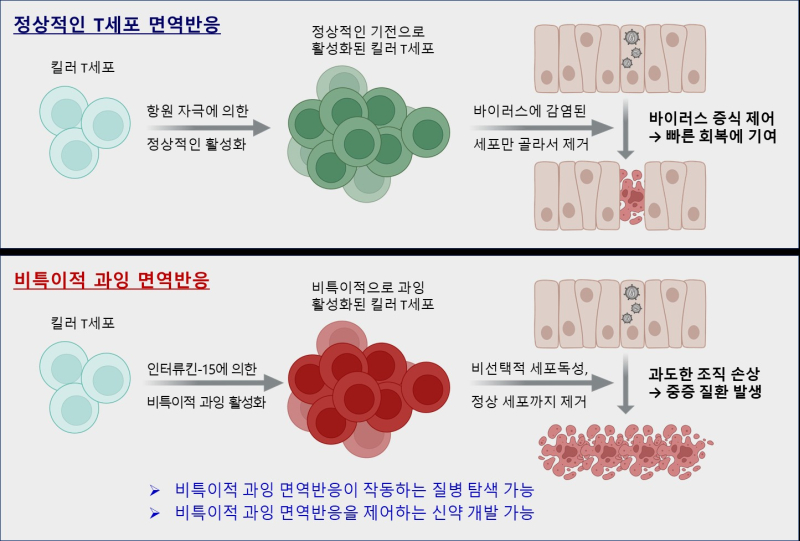
바이러스 감염 시 킬러 T세포(CD8+T세포)는 병원체 제거에 기여하지만, 항원 비특이적 자극으로 기존 기억 T세포가 과도하게 활성화되면 염증과 조직 손상을 유발하기도 한다.
특히 사이토카인 중 ‘인터류킨-15’는 킬러 T세포의 비특이적 세포독성을 유도해 여러 감염·염증성 질환에서 면역병리의 주요 축으로 지목됐지만, 분자 수준의 원리는 명확하지 않았다.
KAIST 의과학대학원 신의철·박수형 교수팀이 충남대의대 은혁수 교수와 공동연구로 킬러 T세포의 비특이적 활성화가 일어나는 분자적 원인을 규명하고, 이를 조절할 수 있는 새로운 치료 전략을 제시했다.
연구팀은 앞서 2018년 세계 최초로 사이토카인에 의해 비특이적으로 활성화된 킬러 T세포가 아무 세포나 무작위로 공격한다는 사실을 규명, 이를 비특이적 T세포 활성화로 명명했다.
이번 연구는 그 후속 연구로, 비특이적 T세포 활성화의 분자적 기전을 밝힌 것으로, 향후 면역 과잉반응을 조절하고 면역질환 치료제 개발의 실마리가 될 것으로 기대된다.
연구팀은 사이토카인 중 ‘인터류킨-15(IL-15)’에 주목했다.
실험결과 IL-15는 킬러 T세포를 비정상적으로 흥분시켜 감염되지 않은 세포까지 공격하게 만들지만, 반면 바이러스 감염 등 항원 자극이 있을 때는 이런 과잉반응을 억제했다.
이 억제작용은 세포 내 칼슘농도가 변하면 칼시뉴린 단백질이 작동하고, 이 신호가 조절 단백질 NFAT를 움직여 킬러 T세포의 행동을 제어함을 확인했다.
이는 IL-15 신호에 의해 활성화되는 세포 내부 칼시뉴린–NFAT 경로가 브레이크 역할을 하기 때문이다.
아울러 연구팀은 일부 면역억제제가 칼시뉴린 경로를 차단해 면역을 억제하는 것이 아닌, 오히려 특정 상황에서는 IL-15에 의한 킬러 T세포의 과도한 활성화를 촉진할 수 있음을 확인했다.
이는 면역억제제 작용이 모두 동일하지 않고 환자의 면역 반응에 따라 약제를 신중히 선택해야 함을 의미한다.
또 연구팀은 유전자 발현 분석을 통해 IL-15에 의해 비정상적으로 활성화된 킬러 T세포에서만 증가하는 유전자 세트를 찾아냈다.
이 마커가 급성 A형간염 환자의 킬러 T세포에서도 뚜렷하게 증가함을 확해 해당 마커를 질병 진단에 활용할 수 있는 가능성을 제시했다.
이번 연구는 중증 바이러스 감염, 만성 염증성 질환, 자가면역질환, 장기이식 거부반응 등 다양한 면역질환의 발병원인 이해에 중요한 단서를 제공하고, IL-15 신호를 표적으로 하는 새로운 면역조절 치료제 개발에도 기여할 전망이다.
신 교수는 “킬러 T세포는 단순 방어자가 아니라 염증 환경에 따라 비특이적 공격자로 변할 수 있다”며 “비정상적인 활성화를 정밀하게 조절하면 난치성 면역질환에 대한 새로운 치료법을 개발할 수 있을 것”이라고 말했다.
한편, 이번 연구는 KAIST 의과학대학원 이호영 박사와 김소영 박사과정이 공동 제1저자로 참여했고, 연구결과는 지난달 31일 국제학술지 ‘면역학(Immunity)’에 게재됐다.
(논문명: TCR signaling via NFATc1 constrains IL-15-induced bystander activation of human memory CD8+ T cells, DOI: doi.org/10.1016/j.immuni.2025.10.002)











