KAIST 화학과 전용웅 교수팀이 mRNA가 단백질을 만드는 시작점과 속도를 조절해 기존 mRNA 치료제의 부작용을 줄이는 핵심 기술을 세계 최초로 개발했다.
이번 연구성과는 mRNA 치료제의 부작용을 근본적으로 줄이는 것을 물론, 뇌졸·암·면역질환 같은 정밀한 단백질 조절이 필요한 치료 분야에 응용할 수 있어 차세대 mRNA 치료제 개발의 중요한 전환점이 될 전망이다.
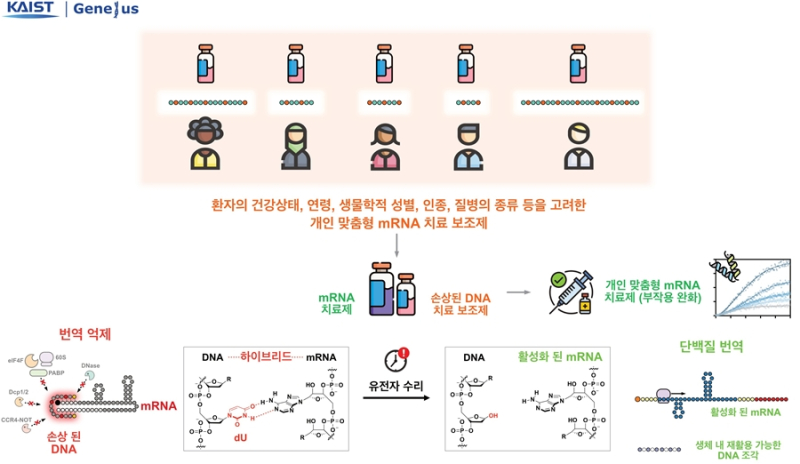
연구팀은 mRNA가 몸속에서 단백질을 한꺼번에 너무 많이 만드는 문제를 해결하기 위해 단백질 생성이 시작되는 순간을 부드럽게 늦추는 새로운 전략을 제시했다.
mRNA는 세포가 단백질을 만드는 데 필요한 설계도 같은 분자다.
최근 팬데믹 때 등장한 코로나19 백신도 이 원리를 이용해 바이러스 단백질 정보를 몸에 전달하는 방식으로 작동한다.
그러나 mRNA 치료제를 몸에 넣으면 세포 속 단백질 제조기계인 리보솜이 설계도에 급격히 몰리면서 단백질이 순식간에 만들어지는 경우가 많다.
이 과정이 너무 빠르면 폐색전증, 뇌졸중, 혈전증, 자가면역질환 등의 심각한 부작용이 발생할 수 있기 때문에 단백질 생성 속도를 조절하는 기술이 중요하다.
이에 연구팀은 단백질 생성이 시작되는 과정에 주목했다.
단백질이 만들어지려면 리보솜이 mRNA에 달라붙어 작업을 시작한다.
연구팀은 이 순간을 미세하게 늦추면 단백질이 폭발적으로 만들어지는 현상을 막을 수 있다고 가정했다.
이를 위해 연구팀은 복잡한 화학기술 대신 인위적으로 손상시킨 DNA 조각을 mRNA에 붙이는 방법을 개발했다.
이 손상 DNA 조각은 작은 방패처럼 작용해 리보솜이 mRNA에 바로 달라붙지 못하게 만들어 단백질 생성이 느리고 부드럽게 전개된다.
손상된 염기는 체내 수리 효소가 제거하고, DNA와 mRNA는 자연스럽게 분리된다.
이때 리보솜이 mRNA에 순차적으로 결합해 단백질 생성 속도가 정상 모드로 전환되면서 단백질이 갑자기 쏟아져 나오는 기존 문제를 해결했다.
연구팀이 사용한 손상 DNA는 체내에서 자연적으로 재활용되는 안전한 생체물질로, 비용도 매우 저렴해 이를 mRNA와 주사 직전 섞으면 실제 의료 현장에서 사용하기에 부담이 없는 것도 강점이다.
연구팀은 손상 DNA의 길이와 손상 정도를 조절하며 단백질 생성이 언제 시작되고 얼마나 천천히 진행될지 정밀하게 설계할 수 있음을 확인했다.
이를 활용하면 여러 종류의 mRNA를 한 번에 투여해도 단백질이 원하는 순서로 차례대로 생성되도록 제어할 수 있어 복합치료에도 효과적일 것으로 기대된다.
전 교수는 “이번 기술은 mRNA 치료제의 안전성을 높이는 동시에 암과 유전병 같은 다양한 질환에 맞춘 정밀 치료로 확장될 기반이 될 것”이라고 설명했다.
한편, 이번 연구는 KAIST 화학과 최지훈·정태웅 박사과정이 공동 제1저자로 수행했고, 연구결과는 지난달 6일 국제학술지 ‘앙게반테 케미(Angewandte Chemie International Edition)’에 게재됐다.
(논문명 : ‘Harnessing Deaminated DNA to Modulate mRNA Translation for Controlled and Sequential Protein Expression’ DOI는 10.1002/anie.202516389)











