한국생명공학연구원(이하 생명연)이 암과 염증 반응의 주요 지표 단백질 ‘인터루킨-6(IL-6)’을 극미량 수준까지 감지할 수 있는 나노바디 기반 초정밀 바이오센서를 개발했다.
생명연 바이오디자인교정연구센터 우의전 박사 연구팀은 췌장암·신장암 환자 혈액 속 IL-6 농도를 정밀하게 구분할 수 있을 만큼 높은 민감도를 구현, 기존 상용 진단법보다 감도를 1000배 향상시키는데 성공했다.
이 기술은 암, 패혈증, 자가면역질환 등 염증성 질환의 조기 진단과 예후 모니터링 등 차세대 진단 플랫폼에 적용될 것으로 기대된다.
낙타 항체서 착안한 나노바디
기존의 단백질 진단법은 정밀하지만, 분석 시간이 길고 숙련된 인력이 필요해 신속한 현장 진단에 적합하지 않았다.
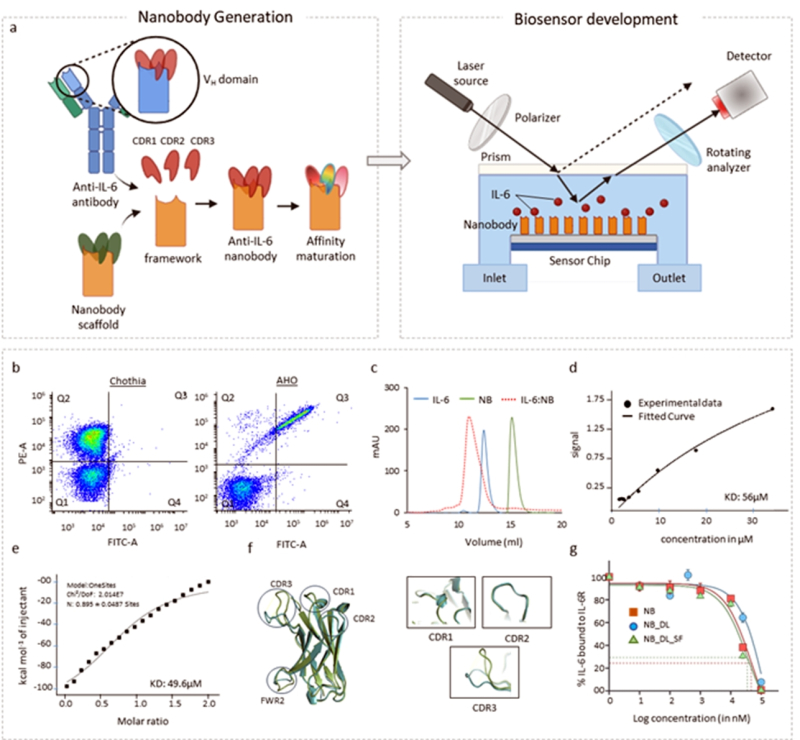
연구팀은 이런 한계를 극복하기 위해 낙타나 라마의 항체에서 유래한 초소형 단백질인 ’나노바디‘에 주목했다.
나노바디는 일반 항체의 10분의 1 크기지만, 구조가 단단해 열이나 환경 변화에도 강하고 세균에서도 대량생산할 수 있다.
연구팀은 기존 항체의 핵심 결합부위(CDR)만을 정밀하게 떼어내 ’CDR 그래프팅‘ 기술로 나노바디 구조에 이식했다.
이는 동물실험 없이도 특정 단백질을 정확히 인식하는 맞춤형 나노바디를 신속하게 제작할 수 있는 게 특징이다.
실험결과 새로 만든 나노바디는 기존 항체보다 최대 53배 높은 결합력을 보였다.
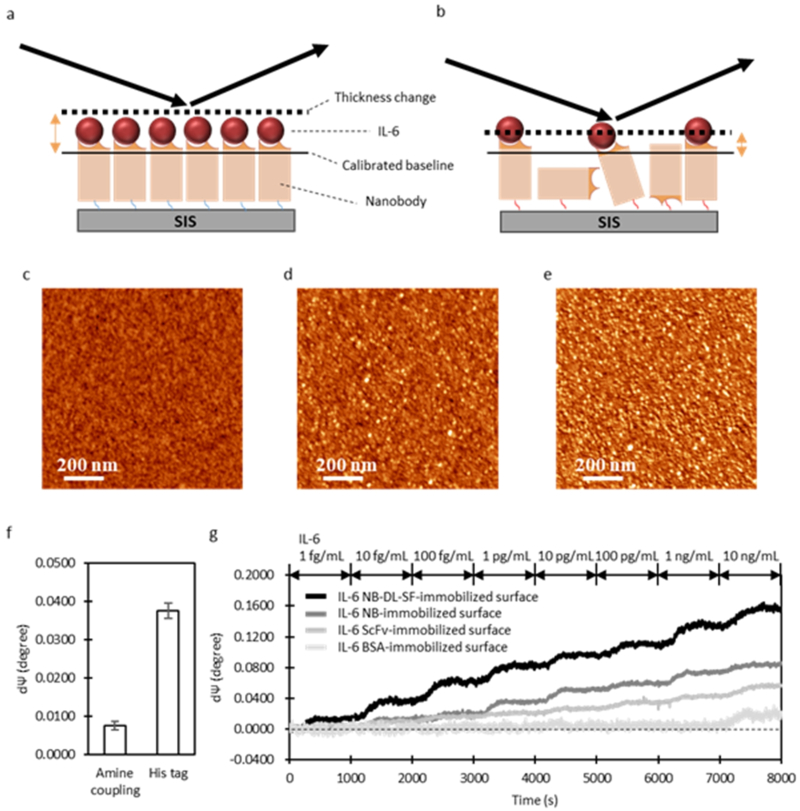
연구팀은 이 나노바디를 한국표준과학연구원(KRISS)이 보유한 ‘SIS(Solution-Immersed Silicon) 센서’와 결합했다.
이 센서는 액체에 담긴 실리콘 칩 표면에서 빛의 반사 변화를 감지해 분자가 붙는 정도를 실시간 측정하는 장치로, 금속을 쓰지 않아 신호 간섭이 적고 수용액 환경에서도 안정적으로 작동한다.
연구팀은 나노바디를 센서 표면에 촘촘히 부착해 IL-6 단백질의 미세한 변화를 감지했다.
그 결과 혈액 속 IL-6 농도가 4.5페토그램(1000조 분의 1g) 수준이어도 검출할 수 있을 만큼 정밀했다.
이는 기존 ELISA 진단키트보다 약 1000배 높은 감도로, 세계 최고 수준의 정확도를 기록했다.
실제 췌장암과 신장암 환자의 혈청을 분석한 결과 건강한 사람과의 차이를 명확히 구분했고, 측정 결과는 기존 검사법과 상관계수 0.96 이상으로 높은 일치도를 보였다.
조기진단·응급의료용 현장진단 적용
이번 연구는 단순한 센서 개발을 넘어 항체를 나노바디로 직접 전환할 수 있는 설계 플랫폼을 제시한 점에서 의미가 크다.
이 플랫폼을 활용하면 기존 확보한 항체를 빠르게 나노바디로 바꿔 다양한 질병 진단에 적용할 수 있다.
특히 크기가 작고 안정적인 나노바디는 센서 표면에 고밀도로 부착할 수 있어 측정 효율을 대폭 높인다.
연구팀은 이 기술이 향후 ‘사이토카인 폭풍(Sepsis)’과 암환자 모니터링, 자가면역질환 등 다양한 질병의 조기 진단과 비침습적 혈액 검사 시스템으로 발전할 수 있을 것으로 기대하고 있다.
또 다중 바이오마커를 동시에 진단하는 AI 기반 고속 스크리닝 플랫폼으로의 확장 가능성도 크다.
이번 연구는 생명연의 나노바디 설계 기술, KRISS의 SIS센서 기술, 한국기초과학지원연구원(KBSI)과 국립암센터의 단백질 분석·임상 검증 역량이 융합된 다기관 협력 성과다.
이 기술은 ㈜에스아이에스센서가 기술사업화에 참여해 향후 센서 칩 대량 생산 및 진단키트 상용화로 이어갈 예정이다.
우 박사는 “이번 연구는 기존 항체를 대체할 수 있는 직접 전환형 나노바디 기술을 실현한 성과로, 면역 동물실험 없이도 고정밀 항체를 빠르게 제작할 수 있는 새로운 길을 열었다”며 “이 기술을 활용하면 극미량의 바이오마커도 정확하게 검출할 수 있어 암, 자가면역질환, 패혈증 등 다양한 염증성 질환의 조기 진단에 큰 도움이 될 것”이라고 설명했다.
이어 “암이나 염증성 질환 등 다양한 질병의 초기 단계에서 미세한 변화를 빠르고 정확하게 잡아내 환자 생존율을 높이는 실질적 진단 기술로 발전시킬 것”이라고 덧붙였다.
한편, 이번 연구성과는 지난달 23일 국제학술지 ‘Chemical Engineering Journal(IF 13.2)‘ 온라인에 게재됐다.
(논문명: Development of a high-sensitivity interleukin-6 biosensor by combining nanobody engineering and solution-immersed silicon ellipsometry / 교신저자 : 우의전(생명연), 김동형(표준연) / 제1저자 : 찬다나, 최정현 ))










