KAIST가 암세포 전이의 비밀을 세계 최초로 풀어냈다.
몸속 세포의 움직임은 상처가 나면 면역세포가 달려가고, 암세포가 다른 기관으로 퍼지는 등 이동이 끊임없이 발생한다.
하지만 세포가 외부의 신호 없이 스스로 어디로 갈지를 결정하는 원리를 지금까지 알지 못했다.
세포가 스스로 길을 정하는 자율주행 메커니즘
KAIST 생명과학과 허원도 석좌교수팀은 바이오및뇌공학과 조광현 석좌교수팀, 미국 존스홉킨스대 이갑상 교수팀과 공동연구로 세포의 자율이동 원리를 규명했다.
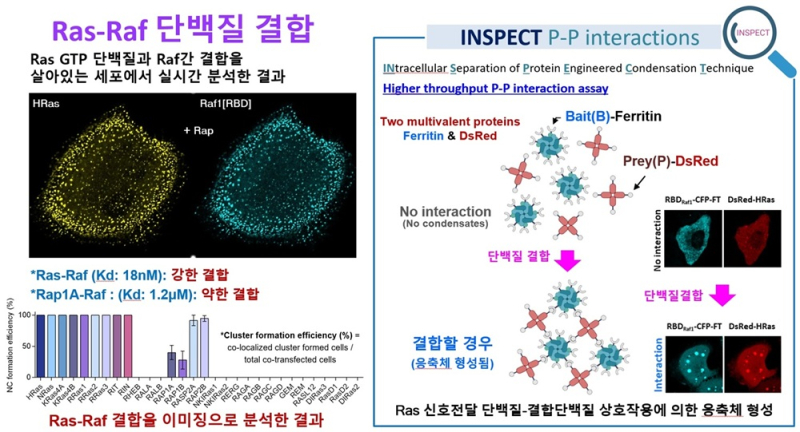
공동연구진은 세포 속 단백질이 서로 어떤 관계를 맺고 있는지를 ‘눈으로 직접 볼 수 있는 ‘INSPECT(INtracellular Separation of Protein Engineered Condensation Technique)’를 개발했다.
이 기술은 세포 속 단백질이 붙었다 떨어질 때 생기는 응집체를 형광신호로 나타내는 실시간 지도와 같다.
이를 통해 연구진은 세포 이동을 조절하는 핵심인 Rho 계열 Rac1, Cdc42, RhoA 단백질의 작동 방식을 분석했다.
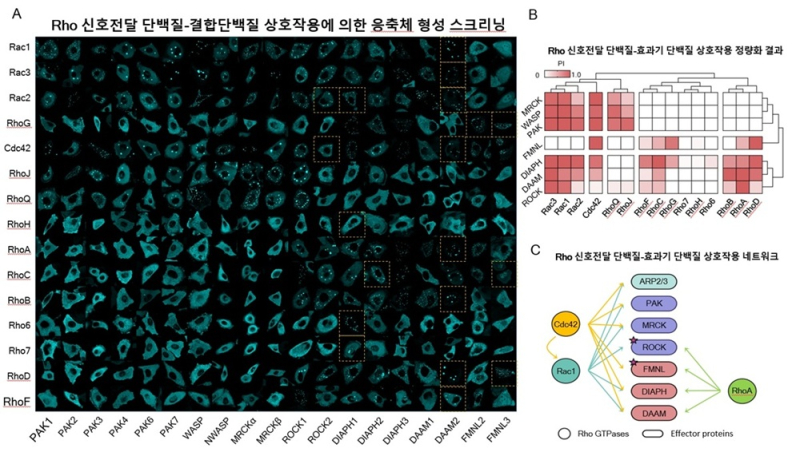
그 결과 이 단백질들은 단순히 세포의 앞뒤를 나누는 역할이 아닌, 결합상대에 따라 세포의 방향을 결정하는 것으로 밝혀졌다.
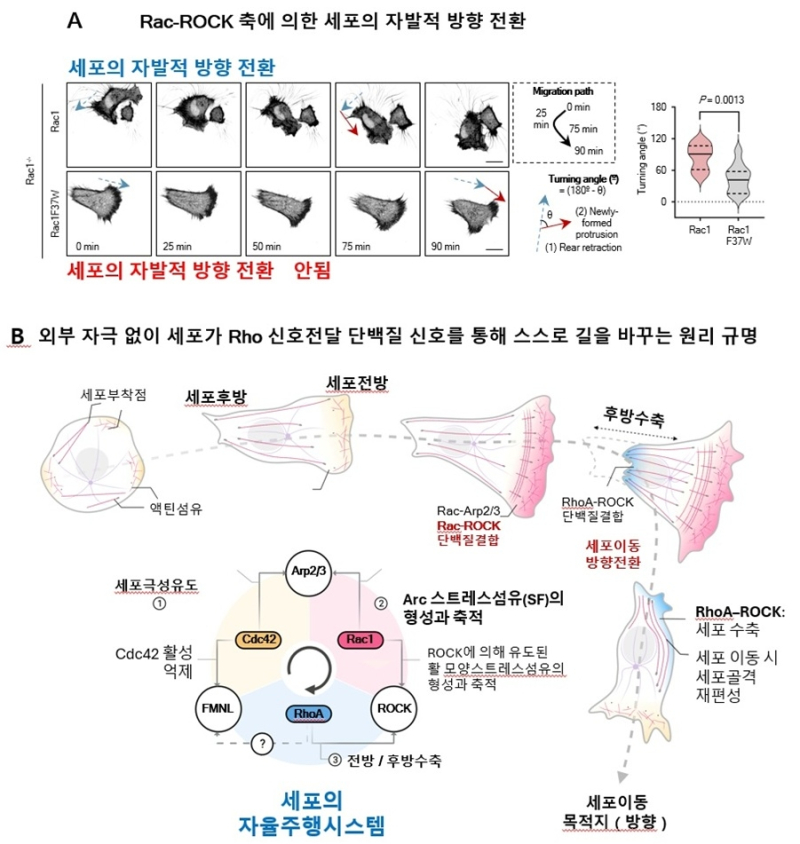
예를 들어 Cdc42–FMNL 단백질 조합은 세포가 직진하도록 만들고, Rac1–ROCK 단백질 조합은 세포가 방향을 바꾸도록 돕는다. 이는 세포가 자동차처럼 핸들과 엔진을 가진 셈이다.
연구진은 이 가설을 검증하기 위해 Rac1 단백질의 37번째 아미노산을 바꾼 결과 Rac1이 ROCK 단백질과 결합하지 못했고, 세포는 방향을 바꾸지 못하고 직선으로만 이동했다.
반면 정상 세포는 Rac1과 ROCK이 결합해 세포 앞부분에 ‘아크 스트레스 섬유’를 만든다.
이 구조가 생기면 세포는 마치 자동차가 코너를 도는 것처럼 매끄럽게 방향을 전환할 수 있다.
반대로 이 결합이 끊어지면 핸들이 고장난 자동차처럼 앞으로만 간다.
또 세포 주변 환경을 바꿔 실험한 결과에서는 정상 세포는 환경이 달라지면 이동 속도를 조절했지만, 핸들기능인 Rac1이 고장난 Rac1F37W 세포는 환경에 상관없이 같은 속도로만 이동했다.
이는 Rac1–ROCK 단백질 축이 세포가 환경을 인식하고 적응하는 능력을 결정함을 뜻한다.
이처럼 INSPECT 기술은 기존 단백질 분석방식과 달리 세포 안에서 실제로 단백질들이 결합하는 모습을 실시간 관찰할 수 있다.
이를 통해 연구진은 단백질 페리틴과 형광단백질 DsRed를 이용해 단백질이 결합할 때 작은 방울처럼 모이는 현상을 형광으로 확인했다.
이를 이용해 15종의 Rho 단백질과 19종의 결합 단백질을 조합, 총 285쌍의 상호작용을 조사한 결과 139쌍이 결합했음을 확인했다.
이번 연구는 세포의 이동이 무작위가 아니라 단백질 간 협력으로 만들어진 정교한 내부 프로그램에 따라 움직인다는 점을 밝혀 큰 의미를 갖는다.
이를 통해 암세포가 어떻게 전이되는지, 면역세포가 상처 부위로 이동하는 과정이 어떻게 조절되는지를 이해하는 데 중요한 실마리를 제공할 것으로 기대된다.
또 약물이 세포의 이동능력에 미치는 영향을 정밀하게 측정할 수 있어 암, 면역, 퇴행성질환 등 다양한 치료의 연구에 새로운 전기를 제공할 전망이다.
허 석좌교수는 “INSPECT 기술은 암 전이, 신경세포 이동, 상처 치유 등 다양한 생명현상의 분자적 메커니즘을 밝히는 데 폭넓게 활용될 것”이라고 말했다.
한편, 이번 연구는 KAIST 이희영 박사, IBS 이상규 박사, ㈜휴룩스 서예지 박사, 김동산 박사(LIBD) 가 공동 제1저자로 참여했고, 연구성과는 지난달 31일 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 게재됐다.
(논문명: A Rho GTPase-effector ensemble governs cell migration behavior ※DOI: https://doi.org/10.1038/s41467-025-64635-0)











