한국뇌연구원이 자폐스펙트럼장애(ASD) 환자에게 발견되는 특정 유전자 변이가 뇌 신경세포의 가소성을 억제하는 원리를 최초로 규명했다.
뇌연구원 정서·인지질환연구그룹 김주현 박사팀은 미국 존스홉킨스의대와 공동연구로 자폐증 관련 유전자 변이 ‘GRIP1-I586L’이 신경세포 간 연결 조절 과정에 이상을 일으키는 분자생물학적 메커니즘을 밝혀냈다.
자폐스펙트럼장애는 사회적 상호작용과 의사소통의 어려움, 반복적 행동 등을 특징으로 하는 신경발달장애로, 발병 원인과 치료법이 명확하지 않아 뇌 기능 이상을 설명할 수 있는 기초연구가 중요하다.
신경세포는 평소 서로 신호를 주고받으며 활동하다가 장기간 신경 활동이 줄어들면, 다음 신호에 더 잘 반응하기 위해 시냅스에 신호 수용체를 더 많이 배치하는 ‘시냅틱 업스케일링’을 한다.
이는 학습과 기억을 가능케 하는 신경가소성의 한 형태다.
그동안 자폐증 환자와 동물 모델에서 이 과정이 제대로 작동하지 않는다는 보고가 있었지만, 그 원인은 밝혀지지 않았다.
연구팀은 자폐증 환자에게서 발견되는 GRIP1 유전자 변이를 생쥐모델에 도입해 사회성 감소와 반복 행동이 증가하는 자폐증 모델을 만들었다.
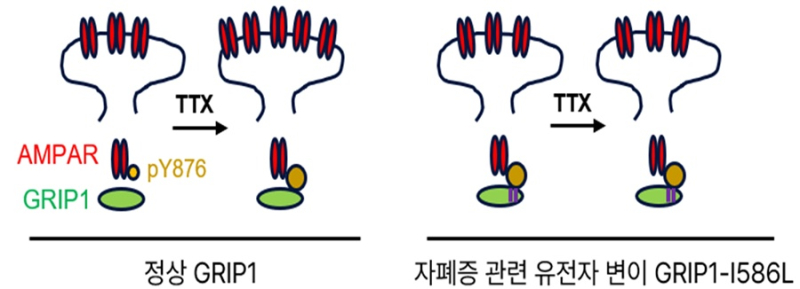
분석결과 이 생쥐의 전전두엽 신경세포에서 시냅틱 업스케일링이 억제됐다.
연구팀은 그 원인을 추적해 GRIP1-I586L 변이로 인해 흥분성 신경전달에 핵심적인 AMPA 수용체(AMPAR)의 구성 요소 GluA2 단백질이 과도하게 인산화된 상태임을 확인했다.
이 변화로 GRIP1 단백질과 AMPAR의 결합이 비정상적으로 강해졌고, 시냅스가 활성화될 때 AMPAR이 이동해야 하는 정상 과정이 막혔다.
그 결과 신경세포가 환경 변화에 맞춰 반응을 조절하지 못하고 가소성이 떨어지는 현상이 나타났다.
김 박사는 “이번 연구는 특정 유전자 변이가 있을 때 뇌 신경세포에서 왜 지폐스팩트럼이 생기는지를 분자 수준에서 규명했다”며 “자폐증의 발병과 진행 과정을 이해하는 데 중요한 단서를 제공해 장기적으로 치료 전략을 넓히는 기초 자료가 될 수 있을 것”이라고 설명했다.
한편, 이번 연구결과는 지난 13일 국제학술지 ‘몰레큘러 사이키아트리(Molecular Psychiatry)’에 게재됐다.
(논문명 : Dysregulated GluA2-Y876 phosphorylation contributes to loss of synaptic upscaling in GRIP1 mutant mice with reduced sociability and increased repetitive behavior)











